Uno studio preclinico, basato sull’utilizzo dell’editing genomico per modificare le iPSC, dà risultati incoraggianti per la sindrome di Wolfram, caratterizzata da diabete mellito
Una malattia neurodegenerativa che tra i sintomi annovera il diabete mellito di tipo I, l’atrofia ottica, il diabete insipido, deficit uditivi e segni neurologici. Questa è la sindrome di Wolfram (WFS), una malattia ultra-rara, di cui sono stati descritti circa 300 casi nel mondo, e attualmente senza cura. Ad oggi, il trattamento è sintomatico e prevede di tenere sotto controllo il diabete con iniezioni di insulina e di gestire al meglio gli altri disturbi correlati. Le terapie avanzate potrebbero essere d’aiuto: un gruppo di ricerca della Washington University School of Medicine (Stati Uniti) ha corretto una variante patogena del gene WFS1 in cellule staminali pluripotenti indotte (iPSC) che, una volta differenziate in cellule pancreatiche, hanno migliorato la secrezione di insulina in risposta ai livelli di glucosio.
Sono due i geni che, se mutati, causano la sindrome di Wolfram: WFS1, che codifica per la proteina denominata Wolframina e che è responsabile della maggior parte dei casi di WFS, e ZCD2 (o WFS2), un gene altamente conservato. La Wolframina è una proteina del reticolo endoplasmatico che protegge le cellule dallo stress, un suo difetto provoca uno stato di infiammazione in grado di condurre all’apoptosi, ovvero alla morte cellulare. Essendo presente in diversi organi (cuore, cervello, placenta, polmoni e pancreas), è facile comprendere quanto i danni della patologia possano essere estesi e portare così a morte prematura. Lo stress cellulare riscontrato a livello del reticolo endoplasmatico nel caso della WFS è rilevabile anche in altri tipi di diabete. Pur essendo disponibile la diagnosi prenatale, si tratta di una malattia talmente rara che sono pochi i medici in grado di diagnosticarla e gestirla al meglio.
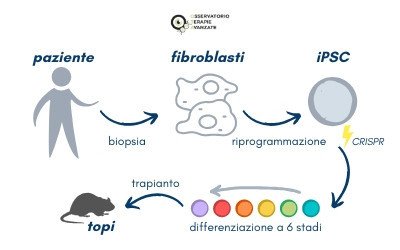
Protagoniste dello studio pubblicato su Science Translational Medicine lo scorso aprile sono le cellule beta pancreatiche, ovvero le responsabili della produzione di insulina, l’ormone che regola i livelli di zucchero nel sangue. La differenziazione di queste cellule dalle cellule staminali pluripotenti indotte (iPSC), derivate dai fibroblasti (cellule del derma) dei pazienti affetti da WFS, promette di fornire cellule autologhe per la terapia di sostituzione cellulare. I ricercatori sono quindi partiti da qui. Nello specifico, le cellule del derma sono state prelevate da tre pazienti con WFS tramite biopsia, una procedura standard per il prelievo di cellule e campioni di tessuto dall’organismo. Successivamente, sono state riprogrammate per essere trasformate in cellule staminali pluripotenti indotte (iPSC): la tecnica, fondamentale nella ricerca sulle staminali, permette di recuperare la pluripotenza – cioè la capacità di generare tutti i tessuti dell’organismo, caratteristica delle cellule embrionali – partendo da cellule adulte e differenziate, che in questo caso sono i fibroblasti. I ricercatori hanno poi utilizzato il sistema di editing genomico Crispr-Cas9 per correggere una variante patogena del gene WFS1 che causa il diabete nella sindrome di Wolfram. Infine, le cellule, dopo essere state fatte differenziare in cellule pancreatiche beta adulte, sono state trapiantate in topi a cui era stato indotto farmacologicamente il diabete. Molti approcci producono cellule beta con scarsa funzionalità in vitro e in vivo ma, in questo caso, grazie a una tecnica innovativa che prevede sei stadi di differenziazione, le cellule beta hanno mostrato, a sei mesi dal trapianto, una migliore secrezione di insulina stimolata dal glucosio e un'inversione dell’andamento del diabete.
Questo studio, seppur agli inizi e in fase preclinica, potrebbe aprire uno spiraglio sulla possibilità di effettuare trapianti di cellule beta autologhe per i pazienti con sindrome di Wolfram e ampliare gli orizzonti per il trattamento del diabete mellito non correlato alla malattia, patologia causata proprio dalla morte o dalla disfunzione delle cellule beta. Sebbene le iniezioni di insulina siano utilizzate come terapia standard, c’è il rischio di complicazioni a lungo termine. Una possibile alternativa è basata sul trapianto delle isole pancreatiche da donatore deceduto, una terapia cellulare a tutti gli effetti, limitata però dal ridotto numero di donatori e dalla necessità di immunosoppressori per ridurre il rischio di rigetto, come per un qualsiasi altro trapianto di organo. Le cellule beta pancreatiche differenziate da iPSC derivate da un prelievo di fibroblasti del paziente potrebbero fornire una fonte di cellule alternativa, anche se la loro ridotta funzionalità aveva frenato i progressi in questo campo. Il miglioramento c’è stato proprio grazie alla tecnica di differenziazione elaborata dal team statunitense che, combinata con l’editing genomico del gene WFS1, genera cellule beta funzionali. Questo permetterebbe ai pazienti di poter usufruire di una terapia di sostituzione basata sulle loro stesse cellule, evitando così i farmaci immunosoppressori. Ovviamente, avendo usato le cellule di tre pazienti con WFS, ci sono delle limitazioni e non è detto che i dati siano validi per i pazienti con diabete non correlato alla sindrome. Saranno necessari altri studi che includano molti più pazienti, non solo con la WFS, in modo da espandere le ricerche e l’ipotetica applicabilità del trattamento ad altre forme di diabete monogenico.
Uno dei parametri di rischio dell’editing genomico sono le mutazioni fuori target (tecnicamente note come “off-target”), che vanno sempre monitorate durante la sperimentazione tramite il sequenziamento. Inoltre, le cellule beta così prodotte non sono ancora completamente mature: occorre quindi migliorare ulteriormente il processo in vista di una possibile applicazione clinica. Come spiegato nello studio, questo approccio, che sfrutta Crispr-Cas9 e un robusto protocollo di differenziazione, consente di studiare queste forme di diabete per la modellazione della malattia e lo screening farmacologico. Le prospettive future includono l’applicazione della combo CRISPR-iPSC-differenziazione a sei stadi per creare una fonte di cellule utile per il trattamento di diversi tipi di diabete e di altri disturbi degenerativi.