Si chiama idecabtagene vicleucel e gli ottimi risultati dello studio clinico di Fase II hanno permesso la sua autorizzazione, negli Stati Uniti, per forme recidivanti o refrattarie del tumore ematologico
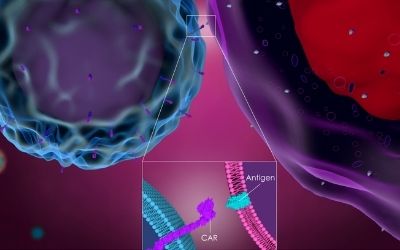
La lista delle CAR-T autorizzate in ambito oncologico continua a crescere: con idecabtagene vicleucel (chiamata più semplicemente ide-cel e, ora, anche con il nome commerciale Abecma), autorizzata dalla Food and Drug Administration (FDA) lo scorso 26 marzo, gli Stati Uniti raggiungono quota cinque. In Europa le CAR-T approvate sono al momento tre e in Italia due, ma la situazione è in continua evoluzione. Ide-cel è una terapia “one shot”, sviluppata da Bristol-Myers Squibb e bluebird bio, basata su cellule T autologhe manipolate geneticamente per puntare all’antigene di maturazione delle cellule B (BCMA) in pazienti con mieloma multiplo recidivante o refrattario dopo quattro o più precedenti linee di terapia. L’autorizzazione del FDA si è basata sui risultati di uno studio clinico di Fase II, recentemente pubblicati su The New England Journal of Medicine, che hanno dimostrato la sicurezza e l’efficacia della terapia.
IL MIELOMA MULTIPLO
Il mieloma multiplo rappresenta uno dei più conosciuti tumori ematologici ed è una patologia cronica dall’andamento spesso infausto, con tassi di sopravvivenza a 5 anni del 51%. Una delle caratteristiche più evidenti di questo tumore - che colpisce le plasmacellule da cui si formano i globuli bianchi - è la tendenza a resistere ai trattamenti: in un certo numero di casi i malati devono sottoporsi a continui cicli di terapia incapaci di arrestare la patologia che intacca pesantemente la loro qualità di vita. Tutto ciò contribuisce a fornire una spiegazione dell’entusiasmo per un nuovo trattamento, come quello prodotto dalle CAR-T, che arriva ad offrire una remissione media di 12 mesi. Infatti, negli ultimi anni l’avanzamento delle conoscenze ha permesso di mettere a punto terapie sempre più mirate contro il mieloma multiplo, in particolare modo i farmaci immunomodulatori, gli inibitori del proteasoma e gli anticorpi monoclonali anti-CD38 diretti contro le plasmacellule. Il loro effetto, tuttavia, ha prodotto un beneficio solo in una parte dei malati mentre in altri la guarigione rimane molto rara.
I risultati forniti dallo studio clinico di Fase II KarMMA, progettato per valutare la sicurezza e l’efficacia di idecabtagene vicleucel, sono stati pubblicati a febbraio sulla prestigiosa rivista The New England Journal of Medicine e sono molto incoraggianti soprattutto per questo secondo gruppo di pazienti. La terapia a base di cellule CAR-T ha prodotto una risposta significativa in oltre il 70% dei pazienti affetti da mieloma multiplo recidivante o refrattario alle terapie. Addirittura un terzo dei pazienti arruolati ha ottenuto una remissione completa dalla malattia.
I RISULTATI DELLO STUDIO KarMMA
Il trial, che ha coinvolto una ventina di centri clinici tra Stati Uniti, Canada, Giappone ed Europa (tra anche l’Italia), è stato condotto su 140 pazienti di età pari o superiore a 18 anni affetti da mieloma multiplo e che avevano precedentemente ricevuto almeno tre dei principali regimi di trattamento per la malattia (farmaci immunomodulatori, inibitori del proteasoma e anticorpi monoclonali anti-CD38 diretti contro le plasmacellule). Condizione necessaria per l’inclusione nello studio era che la malattia fosse refrattaria al trattamento ma senza che vi fossero danni d’organo tali da impedire la somministrazione di ide-cel. L’obiettivo principale dello studio è stato la valutazione di una risposta al trattamento (la miglior risposta o almeno una risposta parziale) e quello secondario è stato la valutazione di una risposta completa. Inoltre i ricercatori si sono proposti di valutare la durata della risposta e gli eventuali eventi avversi associati al farmaco.
Sono stati 128 i pazienti, precedentemente sottoposti ad una mediana di sei trattamenti contro il mieloma, ad aver ricevuto il trattamento basato sull’ingegnerizzazione dei linfociti T. Queste cellule sono state manipolate geneticamente in modo tale da esprimere il recettore chimerico dell’antigene (CAR) che mira all’antigene BCMA espresso sulla superficie delle plasmacellule. I pazienti sono stati ricoverati per poter ricevere le infusioni, precedute dal trattamento linfodepletivo, ed essere monitorati per due settimane, così da poter osservare l’eventuale insorgenza di anemie, neutropenie o trombocitopenie potenzialmente associate al trattamento. Il profilo di sicurezza di ide-cel è risultato molto buono, con un ridotto tasso di tossicità legata alla terapia: nei giorni subito successivi all’infusione la sindrome da rilascio delle citochine e la neurotossicità si sono manifestate, rispettivamente, nell’84% e nel 18% dei pazienti ma nella stragrande maggioranza dei casi si sono rivelate di grado lieve e sono state gestite con successo, a suggello della buona tollerabilità del farmaco. Infatti, molti dei pazienti arruolati - la cui età media è di circa 61 anni - avevano già subito un trapianto di cellule staminali con strascichi decisamente più pesanti di quelli prodotti dalla terapia a base di CAR-T.
Ancora più significativi sono risultati i dati di efficacia. Nello studio i pazienti hanno ricevuto le CAR-T a tre diversi regimi di dosaggio (150x106, 300x106 e 450x106 cellule) ed è stato osservato che, a una mediana di circa 13,3 mesi, quasi due terzi dei pazienti (73%) ha avuto almeno una risposta parziale alla terapia (nel 52% dei casi è stata molto buona) e 42 su 128 (33%) hanno ottenuto una risposta completa. Non solo, ma il tempo mediano di risposta si è rivelato più lungo in base all’intensità della stessa risposta osservata e i pazienti che hanno ricevuto la dose più alta hanno fatto segnare un tempo mediano di sopravvivenza senza progressione della malattia (PFS, Progression Free Survial) di circa 12 mesi. Globalmente la durata della risposta è stata di 10,7 mesi e la PFS di 8,8 mesi ma se si confrontano questi risultati con quelli ottenuti da precedenti terapie i valori scendono a quasi un terzo e ciò è prova della valenza di nuove terapie a base di CAR-T contro le forme recidivanti di malattia.
L’autorizzazione di idecabtagene vicleucel da parte del FDA CAR-T rappresenta un’implementazione dell’armamentario ora disponibile per combattere i tumori del sangue, migliorando così la qualità di vita dei pazienti con mieloma multiplo, come già si sta facendo per le leucemie e i linfomi.