Un’alternativa alle terapie geniche che prevedono di sostituire o correggere i geni difettosi potrebbe celarsi dietro alla trascrizione della molecola che traduce le informazioni dal DNA alle proteine
Le terapie definite “pre-mRNA trans-splicing” potrebbero essere una nuova opzione rispetto alle tecniche ormai più conosciuti di terapia genica. Una strategia emergente di modifica dell’RNA, infatti, ha l’obiettivo di riscrivere lunghi tratti di RNA messaggero (mRNA) difettosi - originati dal DNA con la mutazione genetica - andando ad agire sul meccanismo di passaggio dell’informazione da una molecola all’altra. Questo permetterà di non toccare la doppia elica, evitando tutte le complicanze che questo può comportare, e di ottenere l’effetto voluto. Sebbene l’elenco di strumenti dedicati alla terapia genica e all’editing genomico si stia allungando, fare modifiche consistenti è difficile da realizzare: il trans-splicing del pre-mRNA potrebbe essere una soluzione.
AGIRE SUL PRE-mRNA: COSA VUOL DIRE?
Il dogma centrale della biologia – il passaggio dell’informazione da DNA a RNA, e poi alle proteine – è alla base di questo approccio. Se le tecniche di terapia genica ed editing del genoma hanno l’obiettivo di correggere il DNA e avere delle istruzioni corrette per la cellula, nel caso del pre-mRNA trans-splicing si va ad agire sull’mRNA, cioè la molecola che trasmette le informazioni dal DNA al macchinario deputato a produrre le proteine. Una strada diversa per arrivare alla stessa meta.
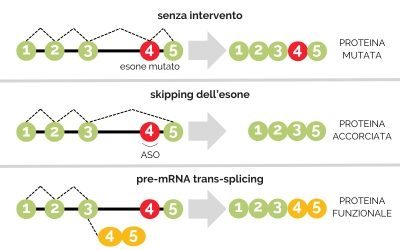
Nel normale corso degli eventi cellulari, durante il processo trascrizionale il codice genetico (DNA) viene letto e viene prodotto un filamento di pre-mRNA, una sorta di bozza di quello che sarà l’mRNA finale. Lo spliceosoma, un grosso complesso enzimatico responsabile del processo di “pulizia” di questa bozza, taglia gli introni e ricuce gli esoni vicini, generando una sequenza di mRNA che codifica la proteina (il prodotto finale). Gli introni, infatti, sono sequenze che hanno un ruolo regolatorio e non vengono tradotte in proteine, mentre gli esoni sono i segmenti codificanti veri e propri e vanno mantenuti. Quando un esone contiene un errore, viene prodotta una proteina difettosa. Da qui i tentativi di trovare una soluzione diversa, specialmente nei casi in cui la terapia genica non può essere utile, ad esempio quando si tratta di modificare tratti molto lunghi del DNA.
DAGLI ASO AL TRANS-SPLICING
Un approccio sono gli oligonucleotidi antisenso (detti anche ASO), brevi sequenze di acido nucleico, che permettono di indurre lo spliceosoma a “saltare” gli esoni difettosi (con un meccanismo noto come exon skipping), producendo così una proteina diversa da quella di partenza. Questa strategia ha dato importanti risultati, diventando una vera e propria terapia, nel caso dell’atrofia muscolare spinale (SMA) e della distrofia muscolare di Duchenne (DMD). Per la DMD il farmaco progettato, e autorizzato negli Stati Uniti, si chiama eteplirsen: è un oligonucleotide che, legandosi al pre-mRNA, impedisce che l’esone 51 venga incluso nell’mRNA e permette di produrre una versione leggermente più piccola della distrofina. Questa proteina è in grado di compensare, anche se parzialmente, l’assenza della distrofina nei pazienti Duchenne.
Il trans-splicing del pre-mRNA fa un ulteriore passo avanti, utilizzando lo spliceosoma per far coincidere un pre-mRNA, che codifica per la proteina di interesse, con un piccolo RNA esogeno, che codifica per la porzione corretta della stessa proteina. Il pre-mRNA soggetto a mutazioni può quindi essere trasformato in un mRNA privo di errori, evitando allo stesso tempo di toccare il DNA.
ASCIDIAN THERAPEUTICS E LA MALATTIA DI STARGARDT
Quello del pre-mRNA trans-splicing è un metodo interessante, che però non è adatto a tutto e, soprattutto, deve recuperare terreno rispetto alla terapia genica e all’editing genomico (delle ultimissime evoluzioni sul fronte dell’editing abbiamo parlato qui e qui) se vuole ritagliarsi il suo spazio. Ora, come raccontato da un articolo su Nature, pare che la strategia del trans-splicing stia facendo capolino in clinica.
L’azienda più avanzata in questo settore è Ascidian Therapeutics, che sta studiando un modo per applicare questa tecnologia alla malattia di Stargardt, un raro di sturbo genetico che colpisce l’occhio ed è caratterizzata da perdita progressiva della visione centrale associata ad obnubilamento della vista (di cui abbiamo parlato qui). Il gene coinvolto è ABCA4, le cui mutazioni causano la morte delle cellule dell’epitelio pigmentato della retina e la conseguente perdita dei fotorecettori. La prognosi è molto variabile, così com’è variabile il decorso della malattia. Ad oggi non c’è cura, anche se sono molte le opzioni terapeutiche in fase di studio, e le misure preventive mirano a rallentare la progressione della malattia.
Una terapia genica già sul mercato per una malattia genetica dell’occhio è voretigene neparvovec (nome commerciale Luxturna), già approvata per l’amaurosi congenita di Leber. In questo caso è possibile usare un vettore virale adeno-associato (AAV), perché il gene da correggere è RPE65 ed è più piccolo, ma esistono altre retinopatie che dipendono da geni troppo grandi per il trasporto con AAV. E tra questi c’è il gene ABCA4. Troppo grande per essere inserito nei vettori virali utilizzati per la terapia genica, ABCA4 ha lo stesso problema che si pone con il gene che codifica per la distrofina. La terapia sviluppata da Ascidian - chiamata ACDN-01 - è pronta per l’avvio dello studio clinico di Fase I/II. L’obiettivo è fornire alle cellule dell’occhio il “modello” per produrre una molecola di RNA che reindirizza lo spliceosoma e permette di sostituire il tratto di pre-mRNA che contiene l’errore. Il trial sarà condotto in quattro centri clinici negli Stati Uniti e i pazienti riceveranno ACDN-01 tramite iniezione sottoretinica in un solo occhio, l'altro occhio servirà da controllo. Verranno valutate la sicurezza e l’efficacia del trattamento.
COME FUNZIONA ACDN-01?
Un transgene ABCA4 completo è di oltre 6.800 nucleotidi, troppo grande per un vettore AAV, che di solito arriva ad una capienza massima di 5000 nucleotidi. ACDN-01 consiste in un vettore AAV caricato con un DNA complementare (cDNA) che codifica un RNA che copre i primi 22 esoni di ABCA4. Una volta iniettato nell'occhio, ACDN-01 entra nelle cellule dei fotorecettori colpite dalla malattia, dove il macchinario trascrizionale entra in azione. Quando lo spliceosoma afferra questa molecola di cDNA, effettua lo splicing del nuovo RNA sulla metà posteriore del pre-mRNA esogeno. Le cellule bersaglio possono quindi produrre proteine funzionali perché l’errore viene bypassato.
La malattia di Stargardt può essere causata da oltre mille mutazioni diverse sul gene ABCA4. ACDN-01 sembra in grado di sostituire circa il 55% di questo gene e potrebbe potenzialmente aiutare circa il 70% dei pazienti affetti dalla malattia. Al momento, i dati di efficienza sono stati ricavati solo su test di laboratorio in vitro e nei modelli animali - e sono ancora in attesa di pubblicazione. Mutazioni in ABCA4 sono legate anche ad altre patologie della vista, che potrebbero beneficiare della nuova strategia, se così possiamo chiamarla. Infatti, i primi articoli scientifici sul trans-splicing risalgono al 1999, ma ai tempi non aveva riscosso molto interesse. Per quanto riguarda i rischi di effetti fuori bersaglio – un tema molto caldo quando si parla di terapia genica ed editing del genoma - il discorso è più semplice rispetto a maneggiare il DNA. Al di là di quante modifiche possono esserci, le conseguenze sono diverse: se viene modificato in modo errato un mRNA, tendenzialmente ci sarà un decadimento immediato (è una molecola facilmente degradabile) e nessuna conseguenza a lungo termine.
A metà giugno Ascidian Therapeutics ha annunciato una collaborazione con Roche per la scoperta e lo sviluppo di terapie basate su questa tecnologia per malattie neurologiche. Ascidian condurrà la parte di ricerca e alcune attività precliniche in collaborazione con Roche, mentre quest'ultima sarà responsabile di alcune attività precliniche e dell'ulteriore sviluppo clinico, della produzione e della commercializzazione.
Le altre aziende citate nell’articolo che lavorano sul fronte del trans-splicing sono Splice Therapeutics e Tacit Therapeutics, che si stanno focalizzando sullo studio delle potenzialità e dei limiti che questa tecnologia offre a livello clinico. Oltre ai geni di grandi dimensioni associati a malattie, un’altra applicazione è quella in cui va regolata l’espressione genica e – si ipotizza – anche per le patologie causate dall’accumulo di proteine mutanti tossiche. Per il momento lasciamo il tempo alla ricerca di fare quello che fa meglio: raccogliere dati, analizzarli e valutare i risultati.