Editing genomico
Editing genomico: che cos'è e a cosa serve? Sarà la terapia del futuro?
L’editing genomico è una tecnologia altamente innovativa che funziona come un “correttore di bozze” del DNA: interviene in maniera precisa per trovare e correggere gli errori genetici all’interno dell’intero genoma. Molti considerano l’editing genomico come la terapia genica del futuro, visto che permetterebbe di correggere un gene difettoso direttamente là dove si trova senza doverne fornire una copia sana dall’esterno.
Una tecnica da Nobel: CRISPR
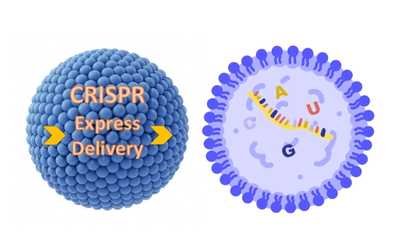
La vera rivoluzione in questo campo è arrivata nel 2012 con la scoperta del sistema Crispr-Cas9, che ha messo in secondo piano i sistemi di editing denominati nucleasi a dita zinco (zinc-finger nucleases), meganucleasi e TALEN che erano stati utilizzati fino ad allora dai ricercatori di tutto il mondo. CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats, espressione traducibile in italiano con brevi ripetizioni palindrome raggruppate e separate a intervalli regolari) ha dimostrato, fin da subito, una potenzialità e una versatilità fino a poco prima inimmaginabili: qualunque tipo di cellula vegetale, animale, inclusa quella umana, può essere modificata geneticamente e la correzione può avvenire anche per un singolo errore, e ovunque nel genoma. Inoltre, questa tecnica è facile da utilizzare, veloce ed economica, tutti fattori che contribuiscono ad ampliarne le potenzialità in ambito terapeutico. Una rivoluzione che ha premiato le sue scopritrici e autrici dell'ormai famoso studio pubblicato su Science nel 2012 - Emmanuelle Charpentier, Direttrice del Max Planck Unit for the Science of Pathogens a Berlino, e Jennifer A. Doudna, Professoressa all’University of California (Berkeley) - a vincere il Premio Nobel per la Chimica 2020 per lo “sviluppo di un metodo di editing genomico” basato su CRISPR.
CRISPR è l’acronimo di “Clustered Regularly Interspaced Short Palindromic Repeats”, ovvero sequenze geniche che si ripetono a intervalli regolari. A CRISPR sono associati i geni Cas ("CRISPR associated", da cui deriva "Crispr-Cas9") che codificano enzimi capaci di tagliare il DNA. Il DNA non viene tagliato in modo casuale, ma in un punto preciso grazie alla presenza di un RNA guida.
Questo sistema è stato originariamente scoperto nei batteri, nei quali agisce come arma di difesa contro i virus - un po' come il sistema immunitario umano - e funziona in maniera molto semplice ma con grande efficienza. Il sistema CRISPR si basa sulla combinazione di due elementi: un enzima Cas e un RNA guida che si appaia al DNA del virus per indicare a Cas il punto in cui tagliare. Come nel caso della terapia genica, anche la strategia di editing basata su CRISPR può essere somministrata in vivo (direttamente nell'organismo) o ex vivo (all'esterno, su cellule vive prelevate dell'organismo).
Ad oggi la ricerca nell’ambito dell’editing genomico spazia dalle malattie genetiche, in particolar modo quelle rare (come la distrofia muscolare di Duchenne, la beta-talassemia e la fibrosi cistica), ai tumori, passando per le malattie neurologiche (Alzheimer e Parkinson), fino alle malattie infettive (HIV). L’utilizzo di CRISPR è inoltre in studio nel campo degli xenotrapianti, in particolare degli organi suini, per la terapia di malattie umane.
In uno studio preclinico su modelli murini condotto dai ricercatori della Johns Hopkins e dell’Università della California è stata testata una terapia basata su CRISPR-Cas13d
La Sclerosi Laterale Amiotrofica (SLA), la malattia di Alzheimer e la malattia di Huntington occupano i primi posti nel capitolo della medicina dedicato alle patologie neurologiche per le quali non sono ancora disponibili trattamenti specifici. L’Huntington è una patologia estremamente rara ma conosciuta per i peculiari sintomi, in special modo quell’insieme di movimenti convulsi e scoordinati che prende il nome di corea. Dal momento della scoperta del gene responsabile della malattia (1993) svariati sono stati i tentativi di individuare una terapia che, purtroppo, ancora non è arrivata. Ma, grazie alle tecniche di editing del genoma il futuro potrebbe riservare nuove sorprese: uno studio, pubblicato recentemente su Nature Neuroscience, evidenzia come il sistema Crispr-Cas13d sarebbe in grado di silenziare i trascritti di mRNA mutanti che sono all’origine della malattia.
- Di: Enrico Orzes
La pandemia ha accelerato i progressi nel campo delle nanoparticelle lipidiche e adesso a beneficiarne saranno le terapie avanzate che si basano sul sistema CRISPR
I problemi della terapia genica sono tre: vettori, vettori, vettori. Il primo a dirlo potrebbe essere stato il premio Nobel Harold Varmus, poi tanti ricercatori hanno ripreso questo slogan che resta tuttora vero. Volendo aggiornare la celebre frase, comunque, si potrebbe aggiungere che le sfide sono tre: manufacturing, manufacturing, manufacturing. In effetti, oltre a progettare sistemi sempre più efficienti e sicuri per trasportare nei tessuti giusti le molecole necessarie a correggere il DNA, bisogna riuscire a produrli su larga scala, per poter rendere i trattamenti disponibili a un numero potenzialmente elevato di pazienti. La buona notizia è che i recenti progressi in questa direzione sono stati notevoli.
- Di: Anna Meldolesi
Sulla base dei risultati di due studi clinici di Fase III, l’Agenzia Europea per i Medicinali ha accolto la domanda di autorizzazione all’immissione in commercio per exa-cel
Si fa più vicino il momento in cui il primo trattamento basato su tecniche di editing del genoma potrebbe varcare le soglie del mercato farmaceutico: si tratta di exagamglogene autotemcel (exa-cel), sviluppato da Vertex Therapeutics e CRISPR Therapeutics (l’azienda fondata dal Premio Nobel Emmanuelle Charpentier). Con un comunicato stampa congiunto, le due aziende hanno annunciato che l’Agenzia Europea per i Medicinali (EMA) ha accolto la domanda di Autorizzazione all’Immissione in Commercio (AIC) per questa innovativa terapia basata sul sistema Crispr-Cas9 e destinata al trattamento dei pazienti affetti da anemia falciforme o da beta-talassemia dipendente dalle trasfusioni (transfusion-dependent beta thalassemia, TDT).
- Di: Enrico Orzes
Un team di ricerca statunitense sta testando una soluzione che permetta al sistema di modifica del DNA di superare le ostili barriere erette dai tumori solidi
Non basta avere una tecnologia avanzata per colonizzare Marte; la sfida è pianificare una strategia per portare le persone sul Pianeta Rosso, superando quegli ostacoli che rischierebbero di annientare gli equipaggi prima del loro arrivo. Lo stesso vale per una risorsa come CRISPR, ormai considerata la punta di diamante nel settore dell’editing genomico: è necessario individuare il modo di far arrivare il bisturi molecolare là dove deve operare e, per fare ciò, occorre sfondare la barricata che i tumori solidi erigono per rendere difficile la penetrazione dei farmaci. I ricercatori dell’University of Texas Southwestern hanno pensato a una soluzione elegante (ed efficace) la cui descrizione è stata pubblicata sulla rivista Nature Nanotechnology.
- Di: Enrico Orzes
Un gruppo di ricerca statunitense ha utilizzato il sistema di editing Crispr-Cas9 per bloccare l’azione di un microRNA. Una strategia che potrebbe ridurre la formazione delle cisti
Una delle prime lezioni che si possono imparare studiando la fisiologia del rene è che il nefrone rappresenta l’unità funzionale di questo importante organo. Formato da un tubulo renale e da un glomerulo - un ciuffo di capillari sanguigni ben aggrovigliati - il nefrone è una struttura complessa, presente in milioni di unità nel rene, dove avvengono le principali reazione che portano alla formazione dell’urina. Malattie come il rene policistico provocano la formazione di cisti a livello del nefrone, ostacolandone le funzioni e compromettendo seriamente la salute di chi ne sia affetto. Ancora non esiste uno specifico trattamento per il rene policistico ma un team di ricerca dell’University of Texas Southwestern Medical Center di Dallas sta studiando una strategia basata sul sistema di editing Crispr-Cas9: i risultati dello studio sono stati pubblicati sulla rivista Nature Communications.
- Di: Enrico Orzes
Sono stati diffusi a dicembre i risultati preliminari ottenuti su due pazienti trattati con la terapia sperimentale EDIT-30. I dati sono promettenti e non è stato osservato nessun evento avverso
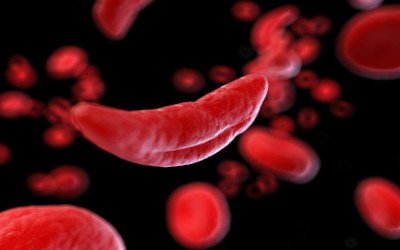
Quando i globuli rossi perdono la loro caratteristica forma discoidale per assumere quella ben più inquietante di una falce significa che ci si trova in presenza dell’anemia falciforme, la più nota malattia ereditaria del sangue, provocata da mutazioni a danno del gene della beta-globina che incidono pesantemente sulla forma dell’emazia. I trattamenti dell’anemia falciforme sono perlopiù sintomatici, volti a ridurre l’anemia e il rischio di infarti cerebrali, ma da anni le prospettive di una terapia che miri alle basi genetiche della malattia stanno portando risultati via via più concreti. Lo dimostrano i primi dati dello studio di Fase I/II RUBY nel quale sono già stati arruolati due pazienti a cui è stata somministrata EDIT-30, terapia sperimentale basata sull’editing genomico.
- Di: Redazione
Agenda
News da CRISPeR MANIA
a cura di Anna Meldolesi