CAR-T e Immunoterapia
CAR-T e immunoterapia: la nuova frontiera delle terapie oncologiche
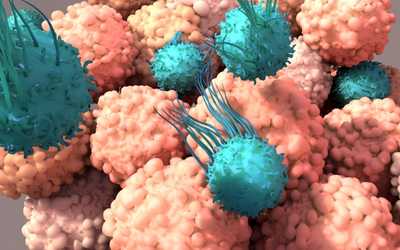
L’immunoterapia è oggi considerata l’ultima frontiera della lotta al cancro e si basa sul concetto rivoluzionario di combattere i tumori come se fossero un’infezione, ovvero “armando” il sistema immunitario del paziente in maniera tale da riconoscere le cellule tumorali e annientarle.
Le cellule tumorali sono cellule che hanno una proliferazione incontrollata e vengono normalmente riconosciute come estranee e dannose dal sistema immunitario, il quale scatena un attacco da parte dei linfociti T, considerati i “soldati di assalto”. Questa difesa dell’organismo non è però sempre efficace perché le cellule tumorali riescono ad attuare tutta una serie di strategie di fuga. Una di queste trae vantaggio dal meccanismo di autoregolazione del sistema immunitario basato su una serie di proteine che agiscono come “acceleratori” o “freni” sulle cellule T.
Una delle strategie di immunoterapia utilizzate oggi, chiamata “inibizione dei checkpoint immunologici”, si basa sull’impiego di anticorpi per disinnescare i freni del sistema immunitario e aumentare così la capacità dei linfociti di fronteggiare i tumori. L’idea, nata negli anni ’90 e arrivata alla prima applicazione terapeutica nel 2011, si è meritata l’assegnazione del Premio Nobel per la Medicina nel 2018.
CAR-T: LINFOCITI T POTENZIATI CONTRO LE CELLULE TUMORALI
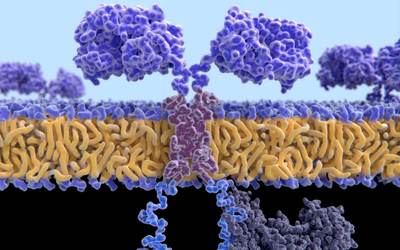
Un’altra strategia, di ultimissima generazione e denominata CAR-T (Chimeric Antigen Receptor T cell therapies), si basa invece sull’ingegnerizzazione genetica dei linfociti T in maniera tale da potenziarli per combattere i tumori. Nello specifico, le cellule T vengono prelevate dal sangue del paziente, modificate geneticamente in modo tale da esprimere sulla loro superficie il recettore CAR capace di aumentare la risposta immunitaria, e reinfuse nel paziente stesso. A differenza della strategia basata sugli inibitori dei checkpoint, le CAR-T rappresentano la medicina personalizzata nel campo dei tumori. Ogni dose viene sviluppata e prodotta per un singolo paziente partendo dalle sue stesse cellule immunitarie. Le prime approvazione per l’applicazione delle CAR-T nei pazienti con alcuni tumori del sangue (leucemia linfoblastica nel bambino e linfoma nell’adulto) sono arrivate nel 2017 negli Stati Uniti e nel 2018 in Europa.
Prof. Dario Sangiolo (Torino): “In uno studio preclinico su modelli in vitro e in vivo abbiamo osservato la capacità delle CAR-CIK anti-CSPG4 di attaccare le cellule di sarcoma”
Alla fine degli anni Quaranta la sensazione di poter esser vicini a infrangere il muro del suono aveva infiammato piloti e ingegneri dell’aeronautica militare: incombeva lo spettro del fallimento ma la sfida era stata lanciata e nessuno si sentiva di abbandonare il campo. Esattamente come sta accadendo oggi con le terapie a base di cellule CAR-T contro i tumori solidi. Il filone di ricerca dedicato ai sarcomi guidato dal prof. Dario Sangiolo - Professore Associato presso il Dipartimento di Oncologia Medica dell’Università di Torino - costituisce, infatti, un promettente trampolino di lancio verso l’oncologia solida. Settore in cui il team del prof. Franco Locatelli ha colto un incredibile recente successo contro il neuroblastoma.
- Di: Enrico Orzes
I dati su 27 bambini trattati in uno studio clinico di Fase I/II con GD2-CART01 sono stati pubblicati sul New England Journal of Medicine e confermano la validità della terapia
Non c’era momento simbolicamente migliore della vigilia di Pasqua per la diffusione di una notizia relativa al raggiungimento di risultati estremamente incoraggianti da parte di una terapia a base di cellule CAR-T destinata a bambini affetti da neuroblastoma. Finalmente, le CAR-T iniziano a produrre successi anche contro i tumori solidi. Teatro dell’importante evento è stata la sala stampa dell’Ospedale Pediatrico Bambino Gesù di Roma, mentre a fornire ai numerosi giornalisti convenuti i dettagli di questo studio - contenuti in una pubblicazione apparsa sulla prestigiosa rivista The New England Journal of Medicine - sono stati gli stessi medici e ricercatori che lo hanno sviluppato, coordinati dal prof. Franco Locatelli.
- Di: Redazione
Lo studio di un gruppo di ricerca italiano dell’Istituto Europeo di Oncologia potrebbe aumentare la resistenza e l’efficacia delle CAR-T, specialmente contro le neoplasie solide
Non tutti i grassi vengono per nuocere. Lo insegnano chiaramente i ricercatori del Dipartimento di Oncologia Sperimentale dell’Istituto Europeo di Oncologia (IEO) di Milano con una recente pubblicazione apparsa sulla rivista Cell Metabolism nella quale descrivono le proprietà dell’acido linoleico in relazione al miglioramento delle terapie a base di cellule CAR-T. Ma in che modo un acido grasso essenziale - indicato anche per il controllo dei livelli di colesterolo nel sangue - può arrecare un vantaggio ai linfociti T modificati con l’antigene CAR per aggredire le cellule tumorali? La risposta ha a che vedere con il microambiente tumorale, ancora oggi il principale ostacolo all’azione delle CAR-T nei tumori solidi.
- Di: Enrico Orzes
Per la prima volta le cellule ingegnerizzate sono state somministrate, con successo, ad un paziente con una rara forma di miosite. Il caso è stato descritto sulla rivista scientifica The Lancet
Situata poco a nord di Norimberga, nel cuore della Baviera, Erlangen è una ridente e tranquilla cittadina sede di un’antica Università su cui nel mese scorso scorsi molti medici e altrettanti giornalisti hanno cercato informazioni. Infatti, presso il Dipartimento di Reumatologia e Immunologia del Policlinico ad essa collegato è stata somministrata per la prima volta una terapia a base di cellule CAR-T a un paziente affetto da una rara e grave forma di miosite: la sindrome da antisintetasi. Il caso, descritto sulle pagine della rivista The Lancet, sembra poter confermare l’efficacia di questi innovativi trattamenti anche contro patologie diverse da quelle tumorali. Nuovi studi clinici sono già ai blocchi di partenza per verificare le potenzialità di questa strategia terapeutica.
- Di: Enrico Orzes
Lo studio di un gruppo di ricerca statunitense suggerisce come puntare ai segnali cellulari per la realizzazione di versioni più efficienti di cellule che sfruttano il CAR per combattere i tumori solidi
Alle terapie a base di cellule CAR-T sono affidate le speranze di quanti cercano una terapia efficace per il cancro poiché esse rappresentano il crocevia di tutte le terapie avanzate: sono, di fatto, una terapia genica, ma considerate anche una terapia cellulare, possono adattarsi ai protocolli di editing genomico e, soprattutto, esprimono le potenzialità del sistema immunitario nel rispondere alle proliferazioni neoplastiche. Tuttavia, il soffitto di cristallo che le cellule modificate per esprimere l’antigene CAR devono ancora sfondare è quello dell’oncologia solida e la chiave di questo risultato potrebbe risiedere nella fine comprensione dei processi di segnalazione cellulare. A spiegarlo è un interessante articolo pubblicato a febbraio sulla rivista Nature Biotechnology.
- Di: Enrico Orzes
La nuova strategia prevede una somministrazione locale di CAR-T dopo un intervento chirurgico di rimozione del tumore. Si tratta di uno studio preclinico, i cui risultati sono molto incoraggianti
Quanti siano stati sottoposti a chirurgia per rimuovere una massa tumorale avranno potuto leggere la dicitura “margini chirurgici” tra le conclusioni del referto operatorio. Si tratta di un parametro essenziale per l’oncologo che, sulla base di esso, stabilisce il proseguo del cammino terapeutico. Infatti, se i margini chirurgici sono positivi significa che è stata rilevata la presenza di cellule tumorali a contatto con la superficie del pezzo operatorio: ciò comporta un rischio di recidiva tumorale, rendendo necessaria la valutazione di una terapia secondaria (ad esempio, radioterapia o chemioterapia adiuvante). Uno studio statunitense, apparso a gennaio sulle pagine della rivista Science Advances, suggerisce la possibilità che un innovativo gel a base di cellule CAR-T possa ridurre in maniera significativa il rischio di recidiva. I risultati dello studio preclinico stanno aprendo le porte ad un trial clinico.
- Di: Enrico Orzes
Agenda
News da CRISPeR MANIA
a cura di Anna Meldolesi