Terapia genica
Trattare le malattie mirando alle basi genetiche
COME FUNZIONA LA TERAPIA GENICA?
Tra le diverse terapie avanzate e di precisione, la terapia genica è una delle prime ad essere state ideate e ha l’obiettivo di trattare una patologia mirando direttamente alle sue basi genetiche. Il concetto base di questa strategia terapeutica è di fornire all’organismo una copia corretta del gene difettoso o un altro gene che possa compensarne il malfunzionamento nelle cellule colpite dalla malattia.
Esistono due principali modalità di somministrazione per la terapia genica:
- in vivo: il “gene terapeutico” viene somministrato direttamente nell’organismo del paziente, mediante un’iniezione per via locale (organo bersaglio) o per via sistemica (nella circolazione sanguigna);
- ex vivo: la correzione avviene all’esterno dell’organismo del paziente. Infatti, le cellule bersaglio vengono prelevate dal paziente, modificate geneticamente, e reintrodotte nel paziente stesso.
Per veicolare il “gene terapeutico” all’interno delle cellule o dell’organismo si utilizzano generalmente dei vettori virali: ad oggi i più utilizzati sono i vettori virali adeno-associati (AAV).
Il potenziale della terapia genica è di enorme portata poiché potrebbe rappresentare una cura per tutta una serie di gravissime malattie per cui oggi non esistono valide opzioni terapeutiche o che richiedono terapie croniche. Ad oggi la ricerca nell’ambito della terapia genica spazia dalle malattie genetiche, in particolar modo quelle rare, al cancro, passando per le malattie autoimmuni e le malattie infettive.
Il concetto di terapia genica nasce alla fine degli anni ‘80 con le nuove tecniche del DNA ricombinante che permettono di costruire pezzi di DNA contenenti sequenze geniche desiderate. Ma è solo negli ultimi anni, con il sequenziamento del genoma e l’avanzare delle biotecnologie, che si sono cominciati a vedere i primi importanti risultati nelle sperimentazioni sull’uomo e le prime terapie geniche autorizzate dall’European Medicines Agency (EMA) in Europa e della Food and Drug Administration (FDA) negli Stati Uniti. In questo ambito l’Italia ha una posizione di eccellenza a livello internazionale: sono diverse le terapie avanzate frutto di ricerche all'avanguardia "made in Italy".
I dati del trial di Fase III sostengono l’efficacia e la sicurezza di lenadogene nolparvovec, terapia genica attualmente in valutazione presso l’EMA per l’Autorizzazione all’Immissione in Commercio
A sostenere la validità del farmaco ci sono i dati ottenuti da diversi studi clinici condotti negli Stati Uniti e in diversi Paesi europei (tra cui l’Italia). In particolare, quelli derivati dallo studio clinico di Fase III REFLECT sono stati da poco pubblicati sulla rivista scientifica internazionale di neurologia BRAIN. In questo trial, la terapia genica sperimentale lenadogene nolparvovec, sviluppata da GenSight Biologics, è stata somministrata ad oltre 90 pazienti che avevano ricevuto una diagnosi di neuropatia ottica ereditaria di Leber (LHON) da non più di 12 mesi. I dati, a 18 mesi dal trattamento, mostrano un miglioramento significativo nell’acuità visiva dei pazienti LHON, con un probabile effetto aggiuntivo quando i pazienti sono trattati bilateralmente. Ora si attende l’autorizzazione di questa innovativa terapia che potrebbe arrivare per l’estate 2023.
- Di: Jung Hee Levialdi Ghiron
La Food and Drug Administration dà il via libera a etranacogene dezaparvovec, in grado di ridurre il tasso di sanguinamenti annuali ed eliminando così la necessità di una terapia profilattica
L’annuncio è arrivato lo scorso 22 novembre dalla multinazionale farmaceutica CSL Behring e l’approvazione da parte della Food and Drug Administration (FDA) statunitense rappresenta una pietra miliare nella storia dell’emofilia B. La terapia genica etranacogene dezaparvovec (nota anche con il nome commerciale Hemgenix®) è stata sviluppata dalla biotech olandese UniQure che ha poi passato la staffetta a CSL Behring, l’azienda ha coperto l’ultimo miglio ottenendo ora la commercializzazione. Il clamore della notizia è tale che, sebbene (per ora) interessi solo il mercato statunitense, se ne parla già anche in Europa, visto che la richiesta di Autorizzazione all’Immissione in Commercio per il vecchio continente è già sul tavolo dell’Agenzia Europea dei Farmaci (EMA).
- Di: Redazione
Hanno 8 e 3 anni i bambini senegalesi, affetti da amaurosi congenita di Leber, trattati con successo grazie alla collaborazione tra il Policlinico Gemelli e l’Ospedale Pediatrico Bambino Gesù di Roma
Gli occhi sono la nostra finestra sul mondo e solo un bambino ipovedente potrebbe spiegarci che cosa vuol dire cercare di intravedere cosa c’è fuori attraverso le tende chiuse. “Era passato meno di un mese dall’intervento quando mio figlio, guardandomi in viso, mi ha detto: Sai una cosa, mamma? Hai degli occhi bellissimi”, racconta mamma Maguiette con la voce rotta dalla commozione. Qualcuno aveva aperto le tende e Abdou riusciva a vedere, per la prima volta in otto anni, gli occhi di sua madre. Il bambino e la sorellina minore Asia, infatti, sono nati affetti da una grave forma di distrofia retinica ereditaria a esordio precoce: l’amaurosi congenita di Leber. Solo in seguito al trattamento con la terapia genica hanno riacquistato importanti capacità visive. Gli interventi sono stati eseguiti in collaborazione dalle unità di Oculistica della Fondazione Policlinico Universitario Agostino Gemelli IRCCS e dell’Ospedale Pediatrico Bambino Gesù nell’ambito di un progetto avviato nel 2021 per la gestione comune di pazienti pediatrici e adulti affetti da degenerazioni retiniche ereditarie.
- Di: Giulia Virtù
Dalla terapia genica all’uso degli oligonucleotidi antisenso, passando per l’editing genomico. Sono diverse le strategie terapeutiche in studio per questa rara malattia metabolica
Un capitolo della medicina che ha risentito in maniera particolarmente positiva dei vantaggi della biologia molecolare è quello delle malattie metaboliche ereditarie nelle quali il deficit di specifici enzimi è causa di un accumulo di sostanze tossiche per l’organismo. Fra tutte spicca la fenilchetonuria (PKU) in cui l’analisi molecolare ha messo in rilievo l’esistenza di molte mutazioni, consentendo agli scienziati di ricorrere allo studio di diverse strategie terapeutiche: dalla terapia genica agli oligonucletotidi antisenso, senza trascurare le nuove tecniche di editing del genoma. Impariamo a conoscerle meglio con il prof. Alberto Burlina, Direttore del Centro Regionale Malattie Metaboliche Ereditarie della Regione Veneto e del Programma regionale Screening Neonatale Allargato per le Malattie Metaboliche Ereditarie dell’Azienda Ospedaliero-Università di Padova.
- Di: Enrico Orzes
Prof. Luigi Naldini (Milano): “Il cardine della ricerca è l’applicazione di una strategia di terapia genica per ottenere una somministrazione di citochine mirata e continuativa”
Da diversi anni si sente parlare sempre con maggior insistenza di immunoterapia, cioè dell’opportunità di sfruttare il sistema immunitario - o perlomeno alcune sue componenti - per suscitare una risposta alla proliferazione dei tumori. L’aspetto affascinante di questo settore della medicina consiste nell’identificare gli elementi chiave dell’organismo da potenziare in maniera tale da metterli nelle condizioni di contrastare lo sviluppo del cancro. È quello che hanno fatto anche i ricercatori dell’Istituto Telethon San Raffaele per la Terapia Genica (SR-Tiget) di Milano attraverso la messa a punto di una innovativa piattaforma di terapia genica per il rilascio di molecole immunostimolanti in un modello di glioblastoma multiforme.
- Di: Enrico Orzes
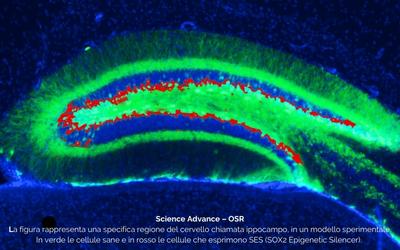
Dott. Alessandro Sessa (Milano): “Ricorriamo alla terapia genica per introdurre nel tumore fattori molecolari sintetici che tengono spenti i bersagli della malattia”
Indagare la biologia di un tumore aggressivo e sfuggente come il glioblastoma multiforme significa descriverne il profilo genetico, guardando ai meccanismi che ne favoriscono la crescita e la diffusione nello stesso modo in cui un ingegnere studia i circuiti di un complicato impianto elettrico. Così, una volta individuati gli snodi principali si possono fare degli aggiustamenti o riparare un danno. È quanto si sono proposti i ricercatori dell’IRCCS Ospedale San Raffaele e dell’Istituto di Neuroscienze del Consiglio Nazionale delle Ricerche di Milano (CNR-In), guidati dal dott. Vania Broccoli e dal dott. Alessandro Sessa, che hanno sviluppato un approccio in grado di silenziare particolari fattori pro-tumorali sfruttando le potenzialità della terapia genica.
- Di: Enrico Orzes
Agenda
News da CRISPeR MANIA
a cura di Anna Meldolesi