News
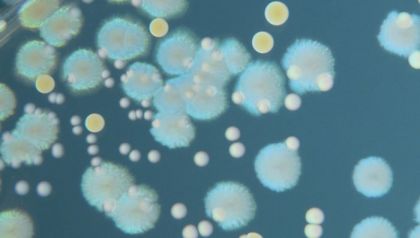
Editing genomico. I superbatteri resistenti nel mirino di CRISPR
CRISPR si è evoluto nei batteri, come arma di difesa dalle infezioni virali. Ma ora i ricercatori stanno puntando la stessa arma contro i batteri stessi, nella speranza di sventare una delle minacce più gravi per la salute globale: la resistenza agli antibiotici.
Un passo avanti in questa direzione arriva con il lavoro pubblicato su Nature Communications da un gruppo canadese della Western University, che descrive un sistema specifico ed efficiente per alterare il microbioma umano con l’aiuto di CRISPR.
La resistenza agli antibiotici è stata proclamata un’emergenza mondiale dall’Organizzazione Mondiale della Sanità. Pochi numeri bastano a rendere l’entità della sfida. I batteri resistenti uccidono 700.000 persone ogni anno e la situazione è destinata a peggiorare. Si stima che nel 2050 il fenomeno potrebbe costare al mondo 100 trilioni di dollari e 10 milioni di vite. L’Italia, purtroppo, non è un’isola felice. Secondo l’Istituto Superiore di Sanità, anzi, i nostri dati sono peggiori della media europea.
- Di: Anna Meldolesi
Immunoterapia: ritirata l’autorizzazione condizionata al commercio di Zalmoxis
MolMed, l’azienda produttrice, comunica che si tratta di una scelta inquadrabile nell’ambito della revisione del piano di sviluppo commerciale del prodotto e delle precedenti interazioni con EMA
Con un comunicato stampa di poche righe diffuso il 10 ottobre MolMed S.p.A., un’azienda biotecnologica da diversi anni impegnata sul fronte della ricerca e dello sviluppo di nuove terapie geniche e cellulari, ha annunciato la propria decisione di ritirare il Conditional Marketing Authorization (CMA) di Zalmoxis, uno dei sui prodotti di punta per il trattamento dei tumori ematologici. La decisione non sembra essere un fulmine a ciel sereno e pare essere stata conseguenza di quanto comunicato a fine giugno quando era stata ufficializzata la sospensione dell'arruolamento di nuovi pazienti all’interno dello studio clinico di Fase III TK008 nel quale veniva usato proprio Zalmoxis. Come si legge nel comunicato stampa allora diramato, “la società ha deciso di effettuare una interim analysis non pianificata sui primi 90 pazienti inseriti nello studio, pari a circa il 50% del totale dei pazienti previsti dal protocollo. Questa analisi, seppur non conclusiva, non ha dimostrato una superiorità del braccio trattato con Zalmoxis rispetto al braccio di controllo trattato con lo standard of care, per ciò che concerne l’endpoint primario dello studio, ossia la sopravvivenza libera da malattia”.
- Di: Enrico Orzes
Terapie avanzate. I sistemi sanitari d’Europa riusciranno a sostenerne l’impatto?
Francesco Macchia, editore di Osservatorio Terapie Avanzate, spiega cosa sono le terapie avanzate e quali sono le difficoltà di accesso a questi trattamenti d’avanguardia
Le terapie avanzate rappresentano le terapie del futuro, quelle che un giorno potrebbero rivelarsi ‘cure’ per un numero sempre maggiore di pazienti. Le potenzialità sono quindi alte ma questo non si traduce automaticamente in accesso ai pazienti. La cruna dell’ago è data sostanzialmente da una serie di politiche sanitarie, che devono tener conto sia della reale efficacia - e sicurezza - di queste terapie sia della possibilità dei vari sistemi sanitari di sostenerne i costi elevati.
In un’intervista pubblicata sulla rivista Policy and Procurement in Healthcare, Francesco Macchia, esperto di politica farmaceutica e sanitaria nonché amministratore delegato di RareLab - la società editrice di Osservatorio Terapie Avanzate - descrive in maniera precisa ed accessibile il confine che esiste tra i farmaci tradizionali e le terapie avanzate.
- Di: Enrico Orzes
CAR-T: arrivano i nomi dei primi centri accreditati in Italia
Non tutti gli ospedali potranno somministrare la terapia ma solo quelli che rispondono a quattro criteri stabiliti da AIFA. Non tutte le regioni hanno selezionato le strutture idonee, attualmente i centri operativi si trovano più che altro al Nord
A due mesi dall’entrata in commercio in Italia di tisagenlecleucel – la terapia CAR-T (Chimeric Antigens Receptor Cells-T) sviluppata da Novartis con il nome commerciale Kymriah – la lista dei centri accreditati dove sarà possibile erogare l’innovativo medicinale, è ancora in via di definizione. Non trattandosi di un farmaco “tradizionale”, che si può trovare già confezionato in farmacia o in ospedale, ma di un farmaco “vivo”, che viene prodotto a partire dalle cellule del paziente stesso, la sua preparazione e somministrazione richiede un iter lungo e complesso. Motivo per cui non tutti gli ospedali potranno erogarla, ma solo quelli che dispongono di particolari requisiti normativi e qualitativi. L’Agenzia italiana del farmaco (AIFA) riporta che “la terapia CAR-T è un trattamento altamente specializzato e personalizzato. Per tali motivi può essere somministrata in un numero limitato di centri di ematologia e onco-ematologia, pediatrica e per adulti, ad alta specializzazione per il trattamento delle leucemie e dei linfomi, con specifici requisiti (tra cui la disponibilità di accesso alla terapia intensiva) e autorizzazioni per le terapie cellulari”.
- Di: Cristina Tognaccini
Agenda
News da CRISPeR MANIA
a cura di Anna Meldolesi