News
Terapia genica: come coinvolgere i pazienti nei trial per malattie rare?
Secondo Paul Gissen del Great Ormond Street Institute è necessario gestire bene l’informazione ai pazienti e avviare una collaborazione con e tra specialisti
La realizzazione degli studi clinici con terapie avanzate per malattie rare che aspettano da molto tempo soluzioni comporta l'identificazione e il superamento di ostacoli non solo scientifici, che sono quelli facilmente intuibili, ma anche operativi, che riguardano in primo luogo i pazienti. Lo sostiene Paul Gissen, Professore di Medicina Metabolica e Direttore dell’area terapia genica e cellule staminali presso l’ospedale pediatrico Great Ormond Street di Londra. Gissen ha condiviso la sua prospettiva con medici e ricercatori nel corso del convegno Advanced Therapies, che si è tenuto a Londra lo scorso 19 e 20 marzo, nel tentativo di aiutare la comprensione degli ostacoli che ancora esistono per l’avvio di una sperimentazione clinica di questo tipo, e di far riflettere sui possibili approcci da attuare.
- Di: Michela Moretti
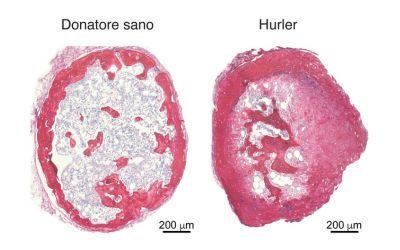
Organoidi di osso per studiare la mucopolisaccaridosi di tipo I
In uno studio della Fondazione Tettamanti e della Sapienza Università di Roma sono state usate cellule staminali scheletriche per riprodurre cartilagine e osso dei pazienti con sindrome di Hurler
Con un semplice prelievo di sangue periferico si riesce a ottenere una straordinaria quantità di cellule da analizzare nella prospettiva di fare diagnosi o inquadrare i dettagli patogenetici di una malattia ematologica. Lo stesso purtroppo non accade con patologie sistemiche, fra cui la sindrome di Hurler (anche chiamata mucopolisaccaridosi di tipo I - MPS I), che interessano anche le ossa e per cui è difficile disporre di campioni bioptici necessari ad allestire modelli attendibili. Una ricerca della Fondazione Tettamanti di Monza e da la Sapienza Università di Roma, da poco pubblicata sulla rivista scientifica JCI Insight, ha permesso di sviluppare un modello tridimensionale di grande rilevanza per capire meglio i meccanismi che inducono la deformazione dell’osso nei pazienti con Hurler. Lo racconta una delle autrici, la prof.ssa Mara Riminucci, del Dipartimento di Medicina Molecolare de la Sapienza Università di Roma.
- Di: Enrico Orzes
CRISPR per eliminare l’HIV dalle cellule immunitarie
Un promettente esperimento di laboratorio, non ancora pubblicato su una rivista scientifica, ha dimostrato che il virus è stato rimosso dalle cellule infettate grazie all’editing genomico
Sebbene in attesa della pubblicazione, nei giorni scorsi la notizia di un nuovo approccio per sradicare l’HIV dalle cellule ha fatto il giro delle principali testate giornalistiche. Una ricerca presentata in anteprima rispetto al Congresso Europeo di Microbiologia Clinica e Malattie Infettiva (ECCMID), che si terrà a Barcellona tra il 27 e il 30 aprile 2024, ha evidenziato come CRISPR possa essere utilizzato per eliminare le tracce di HIV dalle cellule infette. Lo studio, per ora limitato al bancone di laboratorio, potrebbe rappresentare una svolta nella ricerca sull’HIV e aumentare le speranze di trovare una cura, ma la strada da fare per arrivare ai pazienti è ancora molto lunga. La ricerca – per ora introdotta solo tramite gli abstract prodotti per la conferenza e un articolo in preprint – è stata condotta dalla dott.ssa Elena Herrera-Carrillo e da una parte del suo team presso l'University Medical Center di Amsterdam, nei Paesi Bassi.
- Di: Rachele Mazzaracca
Primi organoidi fetali dalle staminali del liquido amniotico
Sono i primi organoidi realizzati con cellule prelevate da gravidanze in corso e aprono nuove prospettive per la diagnosi e terapia personalizzata delle malattie del feto
Nel libro “Il mio paziente non è ancora nato”, Giancarlo di Renzo, ginecologo e ostetrico, racconta la nascita della medicina fetale e come questa sia stata uno “shock culturale”. Se prima il feto era considerato solo un’appendice della madre, oggi qualunque medico sa che durante la gravidanza i pazienti sono almeno due. Ora in una piastra da laboratorio si può addirittura riprodurre una miniatura degli organi fetali a partire dalle cellule staminali prelevate dal liquido amniotico, senza rischi per il feto o per la madre. È ciò che ha fatto un team di ricerca italo-britannico - guidato dal prof. Paolo De Coppi, del Great Ormond Street Institute of Child Health (GOS ICH) all’University College di Londra - il cui studio è stato pubblicato su Nature Medicine. Si tratta del primo organoide fetale di una gravidanza ancora in corso e apre nuovi scenari per la diagnosi e terapia personalizzata delle malattie del feto.
- Di: Erika Salvatori
Agenda
News da CRISPeR MANIA
a cura di Anna Meldolesi